Servicenavigation
Suche

Gleich vorneweg: Eine Welt mit Alkohol statt Wasser wäre keine fröhliche. Ein Blitzschlag und wir hätten im wahrsten Sinne des Wortes Grillwetter. Der Regen prasselt brennend auf uns nieder und von unten schlagen uns die Flammen der brennenden Meere und Seen entgegen. Und selbst wenn wir uns dieser Hölle entziehen könnten, wäre die Erleichterung nur von kurzer Dauer: Das Verbrennen des Alkohols verbraucht allen Sauerstoff und uns ginge im wahrsten Sinne des Wortes die Luft aus. Wobei: Das ganze düstere Szenario ist rein hypothetisch. Weil Alkohol brennbar ist, würde In einer Welt mit Alkohol-Ozeanen gar nie genügend Sauerstoff entstehen. Wir Menschen wären also gar nie entstanden.
Aber seien wir für einmal nicht so wissenschaftlich nüchtern. Lassen wir etwas Phantasie walten und im Laufe des Blogs einige Annahmen treffen. Eine ist, dass wir Menschen auf der alkoholgetränkten Erde leben könnten. Und noch was vorneweg: Der Blog wird keine Ode an den Alkohol.
Das kleine Wassermolekül hat die Eigenschaften, als ob es grösser wäre
Der Grund, dass in diesem Blog als Wasserersatz Alkohol (Ethanol) gewählt wurde liegt darin, dass der Siedepunkt von Alkohol mit 78 Grad relativ nahe an dem des Wassers liegt. In einer Welt mit der uns gewohnten Temperaturen könnte es deshalb auch Alkohol-Regen und Alkohol-Meere geben. Viel realistischer statt Alkohol wären allerdings andere Substanzen wie Methan (wie z.B. auf dem Saturnmond Titan) oder Schwefeldioxid (z.B. auf der Venus). Diese Substanzen sieden jedoch schon bei viel tieferen Temperaturen. Eine Welt, in denen diese Substanzen flüssig sind, wäre für uns eine Kältehölle
Der Siedepunkt von Wasser ist erstaunlich hoch. Grundsätzlich gilt nämlich als Faustregel: Je kleiner und leichter ein Molekül, desto tiefer ist der Siedepunkt. Wasser (H2O) ist ein kleines und leichtes Molekül. Ein Wassermolekül ist sogar weniger schwer als die gängigen Luftmoleküle Sauerstoff und Stickstoff. Man würde also bei Wasser einen tiefen Siedepunkt erwarten. Stattdessen liegt er mit 100 Grad sehr hoch. Dies zeigt sich auch im Vergleich mit dem – chemisch gesehen - grossen Bruder des Wasser, dem Schwefelwasserstoff. In diesem Molekül befindet sich statt einem Sauerstoffatom ein Schwefelatom (H2S). Dieses Molekül ist fast doppelt so schwer wie ein Wassermolekül und siedet dennoch bereits bei -61 Grad.
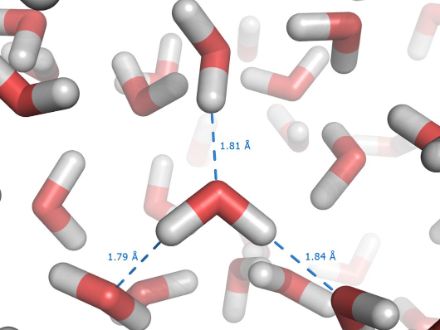
Wassermoleküle halten zusammen
Der Grund für den hohen Siedepunkt des Wassers liegt darin, dass sich die einzelnen Wassermoleküle gegenseitig stark anziehen. Dadurch bilden mehrere Wassermoleküle eine Art loses, grösseres «Scheinmolekül». (Genauere Beschreibungen dieses Phänomens finden Sie im Internet unter dem Stichwort «Wasserstoffbrückenbindung»)
Alkohol wirkt nicht sehr ausgleichend
Wasser ist eine wahre Wärmebatterie. Es gibt keine andere gängige Substanz, die pro Kilo so viel Wärmenergie speichern kann wie Wasser. Kühlt man ein Kilo Wasser und ein Kilo Alkohol um ein Grad ab, so gibt Wasser fast doppelt soviel Wärme ab wie Alkohol. (Wer es genauer wissen will, findet im Internet unter dem Stichwort «spezifische Wärmekapazität» mehr Information.) Auf der Alkohol-Erde sind dies schlechte Neuigkeiten für Europa. Ein Alkohol-Golfstrom wärmt Europa viel weniger als der Wasser-Golfstrom. Wobei: Für Europa kommt es noch schlimmer.
In Europa wird es richtig kalt

Eine weitere, spezielle Eigenschaft des Wassers ist, dass seine feste Form (Eis) leichter ist als seine flüssige Form. Bei den meisten anderen Substanzen ist dies nicht der Fall, so auch nicht bei Alkohol. Auf der Alkohol-Erde freut diese Tatsache die Schifffahrt zu Beginn, denn die Polarmeere frieren vorerst auch im Winter nicht zu. Sobald auf dem Alkoholmeer Eis entsteht, rieselt es zum Meeresgrund herab und der Ozean bleibt befahrbar. Am Meeresgrund sammelt sich jedoch Winter für Winter eine Schicht Eis an. Nach einigen Jahren (Jahrtausenden?) wäre die Eisschicht so dick geworden, dass sie bis an die Meeresoberfläche reicht. Spätestens jetzt ist nicht nur die Schifffahrt unglücklich. Die Untermeergletscher behindern nun auch die Meeresströmungen und somit auch den Golfstrom. In Europa wird es also noch kälter.
Stürmisch, dafür sind die Alkoholgewitter lahm.
Weil die Meeresströmungen ins Stocken geraten, wird der Temperaturunterschied zwischen den Polen und den tropischen Regionen noch grösser. Diese wiederum führt zu heftigeren Stürmen in den gemässigten Breiten. Auf der Alkohol-Erde wäre Europa also ein unfreundlich kalter und stürmischer Kontinent. Ruhiger ist es dafür bei Gewitterlagen.

Gewitter beziehen ihre Energie aus der Wärme, die frei wird, wenn Wasserdampf auskondensiert. Wenn ein Kilo Alkohol auskondensiert, dann wird nur etwa ein Drittel der Energie frei im Vergleich zu Wasser (Mehr finden Sie im Internet unter dem Stichwort «Verdampfungsenthalpie»). Gehen wir davon aus, dass in der Atmosphäre gleich viel Alkohol vorhanden ist wie sonst Wasser. In diesem Fall hätten die Gewitter also nur ein Drittel ihrer Wucht und wären deshalb harmloser. Dasselbe gälte übrigens auch für tropische Wirbelstürme, welche ähnlich funktionieren. Wobei aufgrund der mangelnder Ausgleichswirkung der Alkohol-Meere die Tropen heisser sind, wodurch mehr Alkohol verdunstet, was die Wirbelstürme wieder stärker macht.
Bei all diesen Überlegungen haben wir die Treibhausgaswirkung des Alkohols unterschlagen. Dieser hätte aber sehr starke Auswirkungen auf das Wetter. Aber wir möchten den Rahmen dieses Blogs nicht sprengen und noch weiter ausufern.
Was jedoch klar wird: Mit den anderen im Weltall üblichen Substanzen ist kein Wetter wie auf der Erde möglich.
Ehre, wem Ehre gebührt

Es gäbe noch viel zu beschreiben über das Wasser und seine Eigenschaften, die es als Substanz einmalig machen. Aber vielleicht haben wir ja Ihr Interesse und Ihre Phantasie geweckt und sie spinnen die Idee weiter. Spielerei und wissenschaftliche Erkenntnisse kommen jedenfalls oft Hand in Hand.
Jedenfalls sollten wir nicht bei einem alkoholischen Getränk von einem edlen Tropfen sprechen, sondern bei einem Glas Wasser, denn der Alkohol kann dem Wasser nie das Wasser reichen.